Che cos’è la materia soffice?
La materia si manifesta in varie forme: solida, liquida e gassosa… ma non solo! Molte delle sostanze con cui veniamo in contatto quotidianamente non sono facilmente riconducibili alle prime tre classiche categorie di solido, liquido e gas. Ad esempio in cucina abbiamo dei liquidi non proprio liquidi, quali yogurt, panna montata, maionese, e anche dei solidi non proprio solidi, come il burro, le uova sode o le gelatine…. Anche il corpo umano è pieno di parti molli o di liquidi “strani” (pensiamo solo al sangue, che scorre nelle vene, ma che riesce a coagulare sulle ferite). Abbiamo poi tanti materiali di uso comune come il dentifricio, le creme per il viso, la schiuma da barba, il gel per i capelli… Se dovessimo cercare una proprietà comune a tutti questi materiali, diremmo sicuramente che essi sono “soffici”, perché possiamo facilmente “schiacciarli” e “spalmarli” senza l’ausilio di strumenti particolari. L’abilità a deformarsi facilmente in risposta ad una debole sollecitazione (il coltello che spalma il burro, o le nostre dita che spremono il dentifricio o spalmano la schiuma da barba) rende questi materiali parte della categoria della materia soffice. In realtà la sofficità è legata alle proprietà degli elementi che li costituiscono. Rimane dunque da chiedersi: di che cosa sono fatti i materiali soffici e perché il loro comportamento è spesso intermedio tra quello di un liquido e quello di un solido? Per rispondere a questa domanda dobbiamo analizzare il loro contenuto.
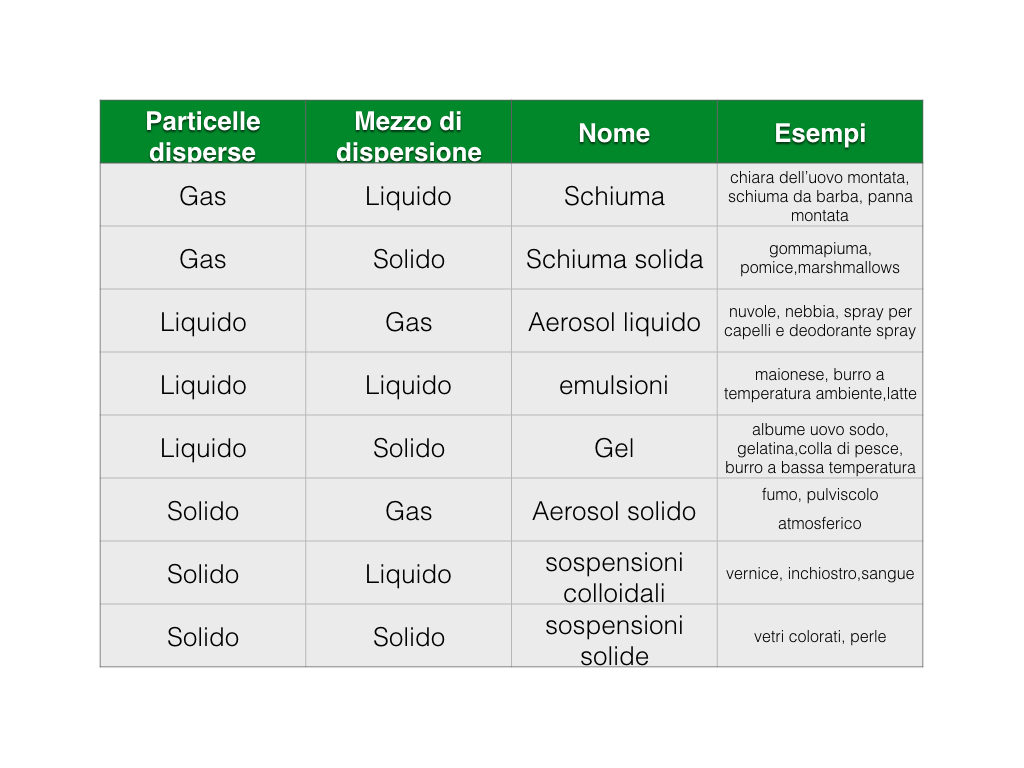
Dispersioni colloidali
Per definire meglio questi materiali prendiamo come esempio il burro. Guardando i suoi valori nutrizionali scopriamo che quasi il 20% è costituito da acqua e il restante 80% è fatto di grassi. Acqua e grasso non amano mescolarsi completamente (i grassi sono sostanze dette idrofobiche), per questo motivo le molecole d’acqua si raggruppano in goccioline disperse nel grasso di dimensioni molto piccole da non poter essere visibili ad occhio nudo ma che sono molto piu’ grandi di una molecola d’acqua. In fisica un materiale di questo tipo viene detto “dispersione colloidale”. La maionese è simile al burro, ma al suo interno ha anche una quantità di aria che le conferisce una maggiore sofficità. Anche il latte è una dispersione colloidale: il 90% del latte è fatto di acqua e la restante percentuale è fatta da piccole macromolecole come proteine (principalmente caseina) e grassi. Anche in questo caso la caseina e i grassi non amano esporsi all’acqua e tendono a stare vicini organizzandosi in piccole strutture sferiche dette “micelle” che riflettono la luce in tutte le direzioni conferendo al latte il tipico colore bianco. Un ulteriore esempio è l’albume dell’uovo che a temperatura ambiente è un liquido un po’ “viscido” e trasparente detto comunemente “sol” formato da acqua al 90% e proteine per il resto. Quando vogliamo che l’uovo diventi sodo, lo portiamo ad alta temperatura; in questa situazione le proteine si “legano” tra di loro e formano una rete elastica detta “gel”.
Basandoci su tutti questi esempi possiamo dire in generale che le dispersioni colloidali rappresentano una vasta classe di materiali la cui caratteristica comune è la presenza di particelle di varia natura (solide, liquide o gassose), grandi approssimativamente un centesimo dello spessore di un capello (e quindi decine di migliaia di volte piu’ grandi di atomi e molecole) e immerse in un secondo materiale. Possiamo dunque parlare di emulsioni nel caso di particelle liquide in un liquido (come nel burro disciolto), di schiume nel caso di bolle di gas in un liquido, di sospensioni colloidali nel caso di particelle di solido in un liquido, di aerosol quando in un gas sono disperse particelle liquide (nuvole, nebbia) o solide (pulviscolo atmosferico). Infine quando la parte solida è maggiore di quella liquida allora parliamo di gel. Una tabella riassuntiva dei vari tipi di dispersioni colloidali è mostrata in Tabella 1.
Tutta questa varietà permette di osservare nelle dispersioni colloidali delle proprietà eccezionali e un comportamento che non troviamo di solito nei liquidi o solidi comuni.
Interazioni colloidali
Non abbiamo ancora chiarito cosa renda soffice le dispersioni colloidali.
Per comprendere cio’ possiamo pensare alle particelle colloidali del paragrafo precedente come dei “super” atomi, ossia come “mattoncini” primari del nostro materiale composti a loro volta da molte molecole. Mentre gli atomi nei materiali convenzionali interagiscono con forze molto intense (il cosiddetto legame covalente), i super-atomi dei materiali soffici si legano attraverso forze molto piu’ deboli dette intermolecolari. Inoltre le particelle colloidali si muovono all’interno di un mezzo (ad esempio nel latte, le micelle di caseina si muovo nell’acqua) subendo l’azione delle molecole in cui sono immerse. Ne risulta che i colloidi sono sottoposti ad un’ulteriore forza data dagli urti con le molecole del mezzo di dispersione che viene detta agitazione termica in quanto dipende dalla temperatura: piu’ alta è la temperatura, maggiori sono gli urti tra i colloidi e le molecole del mezzo di dispersione e dunque l’agitazione termica aumenta. Il comportamento complessivo della dispersione colloidale dipende dal bilancio delle varie forze in gioco: l’agitazione termica infatti impedisce ai super-atomi di legarsi attraverso le forze intermolecolari. Per la maggior parte dei sistemi colloidali, a temperatura ambiente, queste forze risultano paragonabili controbilanciandosi e rendendo i colloidi “poco legati” e di conseguenza il materiale “soffice” quando viene sottoposto ad una sollecitazione esterna.
Una nuova classe di super-atomi
Le sospensioni colloidali possono formare una grande varietà di fasi, in piena analogia con quelle osservate nei sistemi atomici e molecolari. Nel caso delle sospensioni colloidali è possibile però manipolare con facilità le interazioni tra i colloidi permettendo di estendere la gamma di comportamenti osservati rispetto al caso dei sistemi atomici, dando così origine a numerose fasi cristalline, quasi-cristalli, fasi nematiche e liquido-cristalline e ad una varietà di stati solidi “disordinati” (per distinguerli dai cristalli), comunemente chiamati gel colloidali e vetri. Inoltre, grazie alla loro taglia, i colloidi possono essere studiati in dettaglio a livello di singola-particella attraverso un microscopio e la loro dinamica è molto piu’ lenta di quella dei sistemi atomici, il che permette di studiare eventi altrimenti non accessibili alle tecniche sperimentali come ad esempio la formazione di un cristallo. Dunque i colloidi non solo sono importanti perché sono presenti nella maggior parte dei materiali di uso comune, ma sono anche utili alla scienza per capire come si formano particolari stati di cui sappiamo poco e per sperimentare e controllare nuovi meccanismi che permettano di modificare le forze che legano i colloidi tra di loro con l’idea di “progettare” nuovi materiali che si comportino in maniera specifica a seconda del loro utilizzo. I colloidi rappresentano dunque un arsenale di super-atomi dalle proprietà controllabili attraverso diversi parametri e meccanismi. Di seguito descriveremo due metodi di uso comune nella fisica della materia soffice per modificare le interazioni tra colloidi: il primo si basa sull’aggiunta di altre sostanze nella dispersione colloidale; un secondo metodo è quello di creare collodi dalle forme e interazioni particolari.
Forze efficaci
Consideriamo il caso semplice di una sospensione colloidale cioè costituita da particelle colloidali solide in un liquido. Nel gergo scientifico i colloidi si chiamano “soluto” e il liquido in cui sono immersi è detto “solvente”. La manipolazione delle forze in gioco tra i colloidi, dette anche “interazioni colloidali”, puo’ avvenire aggiungendo nella soluzione degli additivi macromolecolari genericamente chiamati “co-soluto”.
Il co-soluto puo’ essere di varia natura ed è di taglia minore del colloide. Molto utilizzati sono ad esempio i polimeri che sono catene di molecole in genere tutte uguali (monomeri) con proprietà chimico-fisiche variabili. Assumiamo inoltre che i colloidi in soluzione (in assenza dei polimeri) si comportino come delle sfere dure, ossia come delle palle da biliardo che urtano tra di loro ma non interagiscono oltre le forze di contatto. La presenza dei polimeri in soluzione cambia notevolmente l’interazione tra i colloidi a causa di un meccanismo detto di “svuotamento”. La situazione è illustrata in Figura 3.
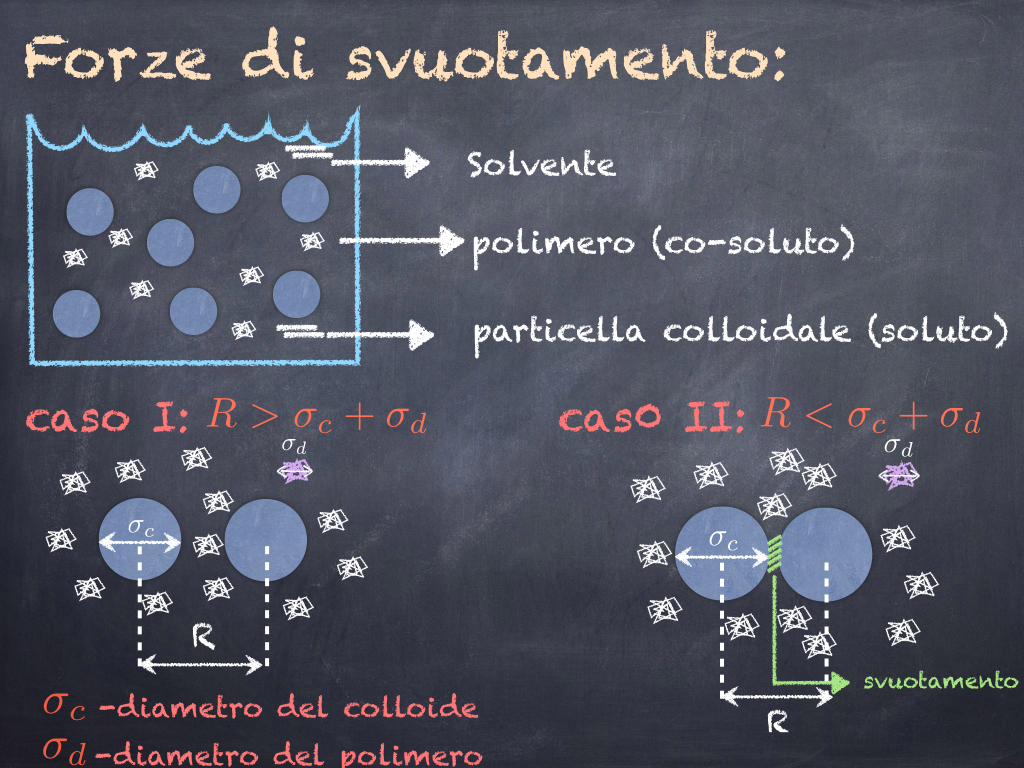
Fig.3 : Forze di svuotamento che si generano nel caso in cui dei polimeri vengano aggiunti nella sospensione colloidale.
Quando i colloidi si trovano a grandi distanze (caso I) essi in pratica non esercitano alcuna forza direttamente l’uno sull’altro e i polimeri non cambiano questa situazione in alcun modo. Inoltre i polimeri possono esplorare liberamente tutto lo spazio attorno ai due colloidi urtando con essi in tutte le direzioni. Esiste però una distanza limite tra i colloidi oltre la quale lo spazio tra di essi non è piu’ accessibile ai polimeri (caso II) in quanto troppo piccolo. Tale regione viene detta di “svuotamento”. In questo caso i polimeri urtano i colloidi solo dall’esterno e la forza generata da queste collisioni non viene bilanciata dalla presenza di polimeri nella regione di svuotamento. Di conseguenza i due colloidi vengono “spinti” uno verso l’altro. Questa spinta dei polimeri fa si’ che i colloidi sentano un’attrazione detta “efficace”, che non viene direttamente generata dalle forze inter-molecolari tra i colloidi ma mediata dalla presenza del co-soluto (i polimeri). Il meccanismo di svuotamento è ubiquo in natura: le prime osservazioni sperimentali risalgono al XVIII secolo, quando venne per la prima volta descritto l’addensamento dei globuli rossi in presenza di proteine. Bisogna aspettare però gli anni ’50 per avere una teoria che descriva tale effetto ad opera dei fisici Asakura e Oosawa.
Recentemente sono state proposte nuove strategie per controllare l’interazione efficace tra colloidi che sfruttano le proprietà del co-soluto di organizzarsi in catene o in aggregati, o che possieda delle fluttuazioni critiche tali da generare forze efficaci aventi un effetto non triviale sull’interazione colloidale. Un esempio su tutte sono le forze critiche di Casimir che si pensa siano presenti nelle membrane cellulari e siano responsabili ad esempio della compartimentazione delle proteine presenti nella membrana.
Colloidi e forze anisotropiche
Un altro modo per far si’ che i colloidi si auto-organizzino in specifiche strutture macroscopiche è giocare con la loro forma e interazione. Da questo punto di vista la chimica della materia soffice ha fatto grandi passi in avanti negli ultimi quindici anni, sviluppando diversi metodi per la “sintesi” (ossia la produzione) di particelle colloidali di vario genere. In natura esempi di sistemi che sfruttano la propria forma per organizzarsi in strutture specifiche sono i virus, le argille, le proteine o le membrane lipidiche; prendendo spunto dalla natura lo stesso concetto puo’ essere esportato nella scienza dei colloidi per creare particelle con anisotropie nella forma e nell’interazione. Infatti l’anisotropia rappresenta l’ingrediente chiave per poter dare vita ad una grande varietà di fasi che altrimenti non sarebbero possibili nel caso in cui i colloidi fossero sferici; ad esempio i cristalli liquidi degli schermi dei nostri cellulari danno origine a delle fasi con proprietà a cavallo tra quelle di un liquido e di un cristallo e percio’ dette liquido-cristalline; in quest’ultime è sempre possibile identificare una direzione preferenziale lungo la quale le particelle si allineano. Ad esempio, nella fase nematica (Fig. 4B) i centri delle particelle sono distribuiti in maniera disordinata come nella fase liquida isotropa (Fig.4A), ma le particelle sono tutte allineate verso una data direzione. I sistemi con anisotropie nella forma possono anche possedere la cosiddetta fase smettica, dove è sempre presente un’orientazione in una direzione preferenziale e le particelle si suddividono in piani paralleli dove i loro centri sono disposti in maniera disordinata (Fig. 4 C).

Fig.4 : (A) fase liquida isotropa; (B) fase nematica;(C) fase smettica. (Cristalli Liquidi di Claudio Zannoni – Enciclopedia della Scienza e della Tecnica (2007))
Queste e molte altre fasi si possono ottenere ad esempio sintetizzando colloidi in forma di bacchette, dischi, ellissoidi, cubi oppure generando delle regioni sulla superficie dei colloidi dove l’interazione è di tipo differente (Fig.5).
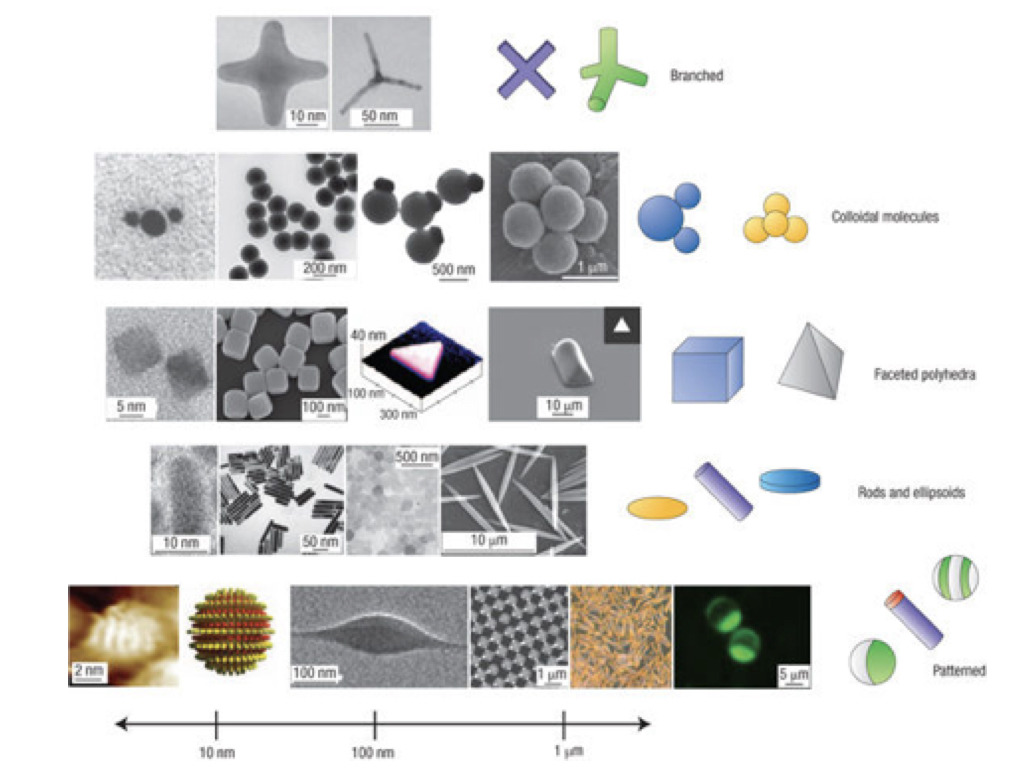
Fig.5 : esempi di “mattoncini” colloidali che possono essere sintetizzati con le tecniche odierne. (Glotzer and Solomon Nature Materials 6, 557–562 (2007))
In natura una situazione del genere si osserva nelle proteine. Esse si legano ad altre proteine attraverso dei siti presenti sulla loro superficie (siti funzionalizzati) che rendono la loro interazione altamente selettiva (non tutti i siti si legano tra di loro) e anisotropa. Per spiegare il comportamento delle proteine, sono stati sviluppati dei modelli semplificati costituiti da sfere dure con delle regioni di legame, dette particelle patchy (Fig.6).
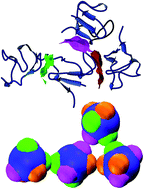
Fig.6 : (in alto) una proteina i cui siti d’interazione sono colorati con diversi colori; (in basso) modello semplificato della proteina utilizzando delle particelle “patchy”. (Fusco and Charbonneau Coll. Surf. B 137, 22 (2016))
Successivamente, con l’avanzamento nelle tecniche di sintesi i colloidi patchy sono stati realizzati sperimentalmente. Nei colloidi patchy, a seconda del numero dei siti funzionalizzati, della loro forma e della loro estensione, è possibile modulare il numero dei vicini con cui si legano al contrario dei collodi con interazione isotropa dove il numero di vicini è fisso (Fig.6); questo permette di ottenere delle fasi gel a bassissima densità rispetto a quelle ottenute con colloidi con legami attrattivi isotropi. I collodi patchy possono inoltre dare origine a fasi cristalline esotiche (come il cristallo di Kagome), tubi, micelle, lamellae ecc. Un esempio di particelle patchy sintetizzate sperimentalmente è mostrato in Fig. 8 assieme ad alcuni esempi di auto-organizzazione delle particelle in particolari forme e cristalli.

Fig.7: esempi di particelle patchy e strutture che possono formare. (Y. Wang et al Nature 491, 51-55 (2012); G. Doppelbauer, E. Bianchi, and G. Kahl J. Phys.: Condens. Matter 22, 104105 (2010);
G. Avvisati, T. Vissers and M. Dijkstra, J. Chem Phys 142, 084905 (2015))
Conclusioni e prospettive
In questo contributo abbiamo brevemente illustrato la materia soffice fornendo esempi di uso comune e cercando di dar luce a ciò che la rende “soffice”. Abbiamo inoltre mostrato come la particolarità della materia soffice sia quella di poter controllare le forze fra i colloidi quasi a nostro piacimento creando una serie di mattoncini colloidali, di tantissime forme e interazioni, che svolgono la funzione di microscopici blocchi LEGO in grado di “incastrarsi” tra di loro fino a formare una struttura finale dalle proprietà specifiche. In questo modo, si possono esportare su scala macroscopica le proprietà incorporate nei singoli mattoncini. Tale tipo di approccio viene detto “bottom-up” (letteralmente “dal basso verso l’alto”). Questa strategia viene oggi perseguita attraverso due approcci complementari: da un lato la sintesi chimica di particelle colloidali sempre piu’ complesse, dall’altro l’aggiunta di co-soluti in sospensione che aumenta la complessità della dispersione colloidale piuttosto che quella dei singoli colloidi. Questo ha permesso già di ottenere diverse osservazioni di cristalli o stati amorfi mai osservati nella materia “dura” e si pone l’obiettivo ultimo di funzionalizzare i materiali colloidali su larga scala, incorporandovi ad esempio una responsività o una elasticità desiderata.