“Molti anni dopo, di fronte al plotone di esecuzione, il colonnello Aureliano Buendia si sarebbe ricordato di quel remoto pomeriggio in cui suo padre lo aveva condotto a conoscere il ghiaccio.” Così comincia Cent’anni di solitudine, il capolavoro di Gabriel Garcia Marquez. Oggi non molti di noi ricordano con la stessa enfasi il loro primo incontro con il ghiaccio: nel freezer di casa, fin da bambini, abbiamo giocato a mettere acqua liquida e ritrovare ghiaccio. Tutti sappiamo bene che l’acqua si può presentare in tre stati distinti, secondo la sua temperatura: liquido, solido o gassoso. Meno evidente è che questo succeda per tutta la materia che ci circonda. Ogni solido, anche il più duro e resistente, fonde a temperature sufficientemente alte. Ogni liquido evapora se sufficientemente riscaldato. A temperature sufficientemente basse ogni gas condensa in un liquido, ed ogni liquido solidifica. Tutta la materia può esistere in tre stati: solido, liquido e gassoso, con buona pace di Aristotele e dei suoi quattro elementi.
Per “transizioni di fase” intendiamo il passaggio di una sostanza da uno stato all’altro, ad esempio da liquido a gas (vaporizzazione), o da gas a liquido (condensazione). I cambiamenti di stato possono avvenire alterando, ad esempio, la temperatura o la pressione della sostanza.
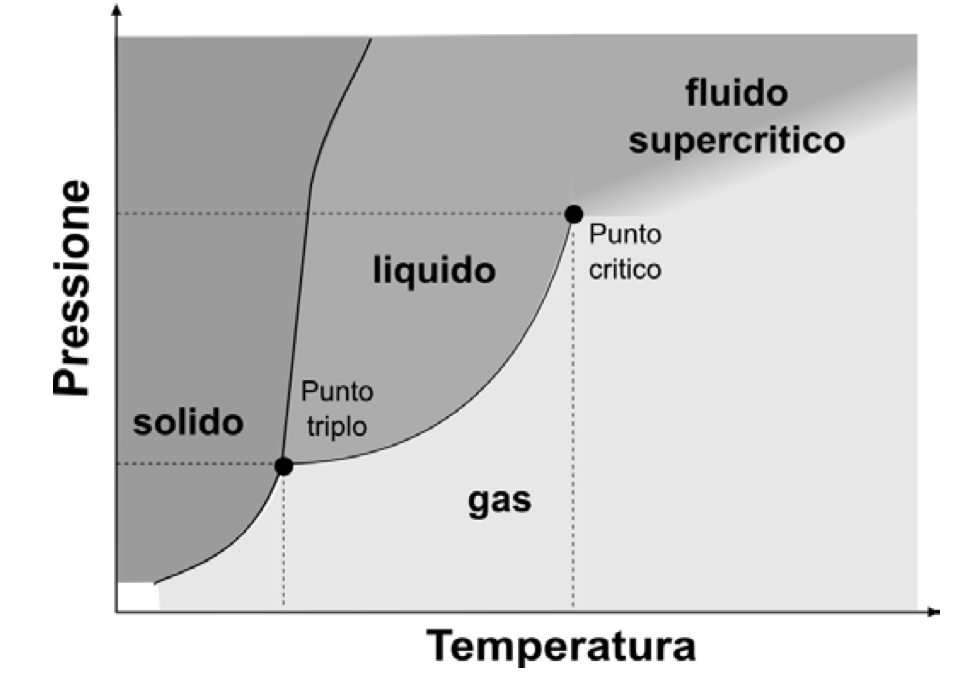
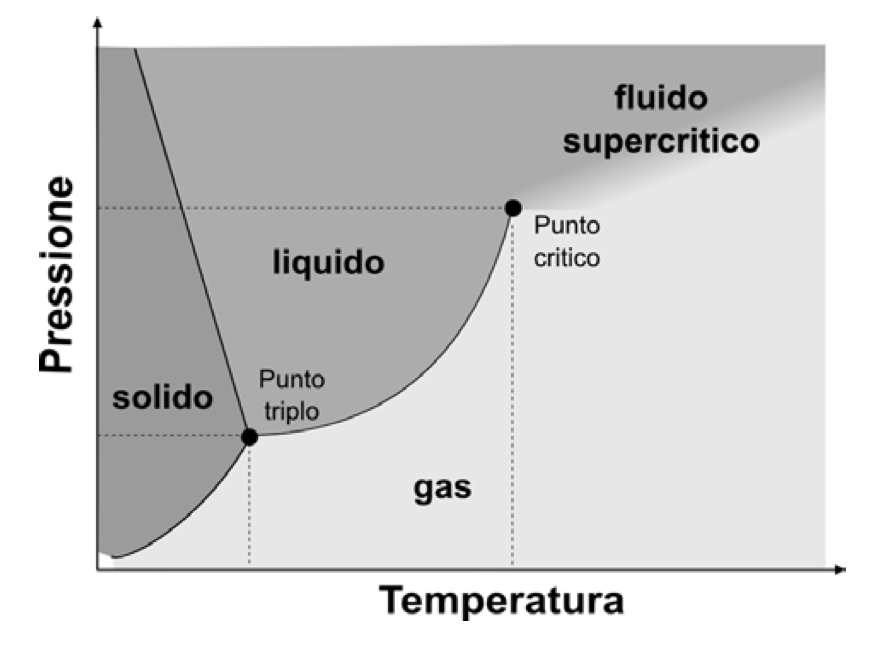
[In figura, il tipico diagramma di fase di una sostanza, in funzione della temperatura e della pressione]
Il cambiamento di fase, però, non avviene improvvisamente e omogeneamente: la nostra pentola d’acqua bollente non si trasforma improvvisamente in una nuvola di vapore. Piuttosto, tenendo la pentola sul fuoco, l’acqua inizia a bollire ed entra in un regime detto di coesistenza di fase. A quei precisi valori di pressione e temperatura la sostanza può ugualmente esistere in due fasi diverse, liquido e gas (vapore). Allo stesso modo, raffreddando dell’acqua (liquida) a pressione atmosferica (ovvero sottraendo progressivamente calore al sistema), possiamo inizialmente osservare la formazione di piccoli cristalli di ghiaccio, non appena raggiunta la temperatura di 0 °C. Continuando a sottrarre calore al sistema, la temperatura resta costante, ma aumenta la quantità di ghiaccio (i cristalli di ghiaccio iniziano a crescere di dimensione) e si riduce quella d’acqua. La miscela acqua-ghiaccio così ottenuta è in una fase di coesistenza: possiamo descriverne lo stato misurando la quantità relativa di ghiaccio e acqua. Le due fasi della sostanza sono in equilibrio: fornendo o cedendo calore possiamo cambiare la frazione di una fase (solido o liquido) a scapito dell’altra.
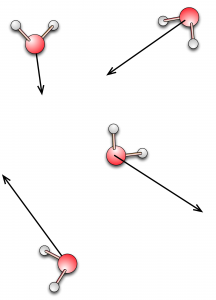
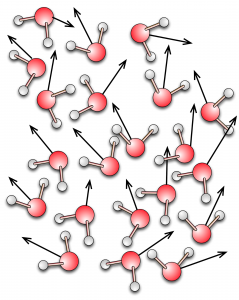
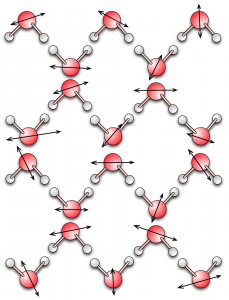
Nelle figure sono rappresentati simbolicamente i tre stati della materia (gas a sinistra, liquido al centro e solido a destra) in termini di densità di molecole, loro velocità (indicata dalle frecce) e disposizione nello spazio.
La descrizione microscopica della materia in termini di atomi e molecole permette di comprendere come una stessa sostanza possa apparire in tre stati completamente diversi a seconda della sua temperatura o della pressione alla quale è sottoposta. Il moto delle sue molecole, ovvero se siano libere di muoversi tra un urto e l’altro (gas), se il loro moto sia influenzato dalle molecole vicine (liquido) o se siano costrette a disporsi nello spazio secondo un ordine geometrico regolare (solido), determina le principali proprietà fisiche che osserviamo su scala macroscopica. Queste proprietà, come tutti sappiamo, sono molto diverse tra loro: solido, liquido e gas rappresentano tre categorie ben distinte nella nostra descrizione del mondo. Quest’osservazione è confermata dal fatto che quando una sostanza si presenta in uno di questi tre stati, le sue proprietà fisiche sono abbastanza stabili.
Tuttavia bisogna tenere presente che in tutte e tre le fasi, sebbene l’energia cinetica delle molecole, e quindi la loro velocità, abbia un valore tipico, sono presenti anche molecole molto più veloci, anche se in numero sempre minore all’aumentare della velocità. Può capitare, allora, che alcune molecole, quelle più veloci che si trovano sulla superficie più esterna del materiale, fuggano via lontano dalla sostanza. É ovviamente il caso di un liquido che evapora: alcune molecole vincono la debole attrazione che causa la tensione superficiale del liquido e volano via. Poiché a volare via sono le molecole più veloci, le più energetiche, l’evaporazione diminuisce la temperatura del liquido: è questo il principio con cui il nostro organismo tenta di abbassare la propria temperatura attraverso la sudorazione. L’evaporazione può ovviamente essere facilitata ventilando la superficie bagnata, in modo da aiutare le molecole a fuggire via. D’altra parte, il processo può avvenire anche al contrario, e molecole esterne al liquido possono entrarvi, specie se abbastanza energetiche: dunque se l’umidità nell’aria è alta (ovvero contiene una grande concentrazione di vapore) l’evaporazione è bilanciata da questo fenomeno di condensazione e la sudorazione non è efficace.
A parte questi fenomeni superficiali, che coinvolgono piccole frazioni di molecole, le tre fasi della materia sono stabili, hanno proprietà fisiche piuttosto diverse tra loro che non mostrano grandi variazioni. Il volume occupato da un chilogrammo d’acqua a pressione atmosferica varia pochissimo se aumentiamo la sua temperatura da 5 gradi a 95 gradi. Invece, quando ci avviciniamo ai 100 gradi, le cose iniziano a cambiare rapidamente e il volume aumenta in maniera sensibile anche solo passando da 99,9999 gradi a 100,0001 gradi! Come sappiamo a 100 gradi l’acqua entra in ebollizione, ovvero anche le molecole all’interno del liquido, non solo quelle sulla superficie, iniziano a liberarsi dall’attrazione reciproca e l’acqua passa dallo stato liquido a quello gassoso.
In altre parole, il passaggio da uno stato della materia all’altra, di solito, è discontinuo e avviene attraverso dei processi di trasformazione repentini, piuttosto che gradualmente. Lo studio di questi passaggi, che come abbiamo detto si chiamano transizioni di fase, hanno rappresentato un campo di applicazione della fisica statistica molto interessante. Le transizioni di fase rappresentano, infatti, un altro caso esemplare di fenomeno che emerge dalla natura macroscopica della materia. I cambiamenti improvvisi e radicali nelle sue proprietà non sono dovuti a un lento adattamento della sostanza a nuove condizioni esterne, ma risultano un effetto del comportamento collettivo dell’enorme quantità di molecole che la costituiscono. Le leggi fisiche che determinano la dinamica di ogni singola molecola non dipendono dalla temperatura o dalla pressione e dunque non cambiano passando da uno stato all’altro della materia: sono invece le proprietà statistiche dell’insieme delle molecole a cambiare radicalmente durante una transizione di fase.
Nel caso dei passaggi di stato della materia, questa discontinuità è dovuta a un cambiamento dell’ordinamento relativo tra le molecole, piuttosto che in un cambiamento della loro energia interna. Durante un passaggio di stato la temperatura della sostanza rimane costante: l’acqua, ad esempio inizia a bollire a 100 gradi, e il calore che il nostro fornello cede alla pentola non ne aumenta la temperatura, bensì determina il cambiamento di fase di una quantità sempre maggiore di liquido in vapore.
Tuttavia, non tutti i cambiamenti di stato avvengono discontinuamente. Alcune transizioni di fase avvengono con continuità. Questo tipo di transizioni continue, sono chiamate del secondo ordine (il nome è legato alle proprietà matematiche dei potenziali termodinamici che descrivono il sistema). Anche durante queste transizioni avviene un cambiamento di ordine interno al sistema, ma in termini diversi da quelli discussi finora. Sebbene queste transizioni possano sembrare un caso molto peculiare, esse rivestono un interesse particolare in fisica. Il loro studio ha portato a dei risultati imprevisti, come anche allo sviluppo di tecniche di calcolo e modelli teorici che hanno trovato riscontri e applicazioni in altri ambiti della fisica e non solo.
Un esempio tipico di transizione di fase continua riguarda le proprietà magnetiche di alcuni materiali metallici. Non si tratta di fenomeni così avulsi dalla nostra esperienza comune. Forse a tutti è capitato di avere in mano una calamita e d’incuriosirsi alle sue proprietà, alquanto stupefacenti. Quando il giovane Einstein, all’età di quattro o cinque anni, vide per la prima volta una bussola, ne rimase completamente affascinato. Come amava raccontare, fu in quell’occasione che egli comprese che “esisteva qualcosa dietro le cose, qualcosa di profondamente nascosto”, alla cui ricerca dedicò quindi la sua attività. L’ago della bussola è un leggero magnete che si orienta secondo il campo magnetico terrestre, ovvero si allinea grosso modo all’asse di rotazione della terra, che a sua volta ha le proprietà di un’enorme calamita.
Tutte le calamite hanno cioè un asse speciale, una direzione particolare che individua i due poli, nord e sud. I poli tendono ad attrarre materiali ferrosi posti in prossimità di essi, come anche tendono ad attrarre poli opposti di altre calamite, mentre respingono poli simili. Ovvero, le calamite tendono ad allineare il proprio asse a quello delle altre calamite con le quali entrano in relazione (ovvero tendono ad allineare il proprio asse ad eventuali campi magnetici esterni). Questa proprietà però non è intrinseca al materiale, ma dipende anche dalla sua temperatura. Se la calamita viene riscaldata a una temperatura superiore a un valore critico, detto temperatura di Curie (dal nome di Pierre Curie che studiò per primo le proprietà termiche dei ferromagneti), essa perde le proprie proprietà magnetiche macroscopiche, ossia questa sua direzione privilegiata di allineamento. Abbassando di nuovo la temperatura sotto la temperatura di Curie, l’asse magnetico ricompare, ma non necessariamente nella stessa direzione. (Tra l’altro anche il campo magnetico terrestre ha subito nel tempo variazioni del proprio asse e anche inversioni dei poli). La temperatura di Curie rappresenta dunque una vera e propria temperatura di transizione critica, chiamata transizione ferromagnetica, che separa due fasi magnetiche distinte del materiale: una fase ordinata, caratterizzata da una direzione privilegiata nello spazio ed una disordinata, al di sopra della temperatura critica, nel qual caso la calamita, nel complesso, non presenta proprietà magnetiche macroscopiche.
Dal punto di visto microscopico, possiamo pensare alla calamita come a un insieme di tanti piccoli magneti che possono, in principio, ruotare il proprio asse, ciascuno in una direzione particolare (anche in questo caso la descrizione microscopica esatta è più complicata, ma possiamo disinteressarcene in questo contesto). Ciascuno di questi minuscoli magneti tende ad allinearsi ai magneti vicini. In assenza di un campo magnetico esterno, però, essi non riescono ad accordarsi facilmente su una stessa direzione: in principio qualsiasi direzione sarebbe buona, se solo i miliardi di magnetini potessero trovare un accordo collettivo. Ahimé!, trovare il consenso non è facile, quando si è in tanti, specialmente quando i singoli individui sono irrequieti: i magnetini infatti si agitano un po’ come le molecole in un gas (o meglio in un solido). La temperatura del materiale indica il loro grado di agitazione indisciplinata, che li porta ad infischiarsene dell’allineamento dei vicini. La transizione ferromagnetica può dunque essere interpretata come il risultato della competizione tra una tendenza all’ordine, causata dall’interazione magnetica tra elementi microscopici, e una al disordine dovuta all’agitazione termica.
Come abbiamo accennato, questa transizione non avviene in maniera improvvisa: piuttosto, quando il magnete raggiunge esattamente la temperatura di Curie, esso viene a trovarsi in uno stato critico, nel senso che è molto suscettibile alle perturbazioni esterne: i minuscoli magneti che lo compongono non hanno ancora individuato una direzione collettiva di allineamento, ma sono pronti a farlo, tutti insieme, se solo gliene viene data l’occasione. Il sistema è estremamente suscettibile, perché i suoi componenti elementari sono in grado di rispondere collettivamente alle minime sollecitazioni esterne.
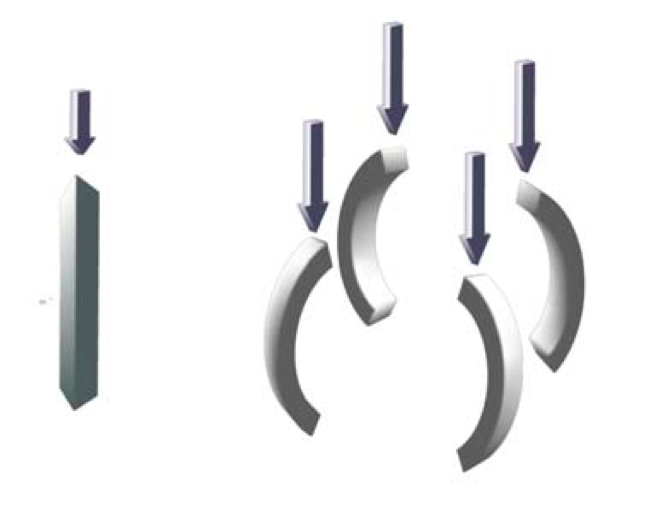
n figura è mostrato un esempio ideale di transizione di fase continua legata ad una rottura di simmetria: esercitando una pressione verticale crescente sull’asta (figura a sinistra) si arriverà a fletterla in una di molte possibili direzioni (figura a sinistra). La direzione di flessione rappresenta una rottura della simmetria iniziale del sistema. La scelta della specifica direzione può dipendere da piccolissime perturbazioni al momento critico in cui sta per verificarsi la flessione.
Possiamo descrivere il fenomeno con un esempio non troppo peregrino. Supponiamo di avere un bastone o un’asta abbastanza flessibile, di puntarne un’estremità al suolo e di esercitare una pressione sull’altra tenendo l’asta esattamente verticale. Se non esercitiamo una pressione molto forte, l’asta sopporterà la nostra azione, rimanendo verticale ed immobile: in principio l’asta potrebbe flettersi, ma anche questa operazione richiede uno sforzo, che potrebbe essere superiore alla forza che applichiamo dall’alto. Aumentando la pressione, però, il sistema diventa via via più instabile, fino a quando l’asta preferirà piegarsi in modo da assecondare la nostra azione di compressione. In quale direzione si fletterà il bastone? Dal punto di vista fisico, il sistema non ha una direzione privilegiata: possiamo ruotare l’asta intorno al suo asse di simmetria (l’asse che la attraversa in lungo) e non noteremo nessuna differenza. Tuttavia, nel momento in cui l’asta si flette, la simmetria del sistema si rompe. È esattamente quello che accade ai minuscoli magneti all’interno della calamita quando la raffreddiamo a una temperatura immediatamente inferiore alla temperatura di Curie: la calamita sviluppa un asse privilegiato lungo il quale si allineano la miriade di magneti elementari. Al punto critico, che nell’esempio dell’asta corrisponde alla pressione critica un attimo prima che il bastone si fletta, il sistema è estremamente sensibile alle perturbazioni esterne: basterà una piccolissima perturbazione, un soffio di vento, per sciogliere la riserva, decidere la direzione in cui flettersi, rompere la simmetria. Questo comportamento collettivo (ogni singola fibra elastica dell’asta deve “decidere” da quale parte flettersi) corrisponde quindi a una rottura spontanea di simmetria.
La fisica degli ultimi cinquant’anni ha visto grandi sviluppi nella comprensione di questi fenomeni e nella loro descrizione. In particolare si è evidenziato che alcuni fenomeni legati alla criticità dei ferromagneti si riscontrano, identici, in sistemi fisici completamente diversi, come appunto nei cambiamenti di stato della materia al punto critico (ma anche nella fisica delle particelle elementari e perfino in cosmologia, nelle ipotesi sui primi istanti dell’universo). Alcune caratteristiche di questi fenomeni sono cioè universali, nel senso chiarito sopra: non dipendono dalla natura specifica delle interazioni tra i costituenti microscopici del sistema in esame, ma emergono come una manifestazione macroscopica di una loro organizzazione collettiva. Questa forma di coordinazione collettiva rappresenta una metafora molto potente per descrivere e comprendere meglio molti fenomeni naturali.
Il caso dell’acqua.
Abbiamo detto che ogni sostanza può manifestare dei cambiamenti di fase, e che durante queste transizioni i comportamenti di sostanze diverse possono essere molto simili. Esistono però alcune piccole differenze per alcune sostanze, che fanno eccezione. Uno di questi casi eccezionali è quello dell’acqua.
Di solito è possibile solidificare un liquido diminuendo la temperatura. Un metodo alternativo è quello di aumentare la pressione a cui è sottoposto.
Questo significa che a partire dalla fase liquida, possiamo solidificare la nostra sostanza aumentando la pressione esercitata su di essa: ovvero possiamo comprimere il sistema, tenendo la temperatura costante. Questo non ci stupisce, poiché normalmente la fase solida è più densa di quella liquida: ovvero, a parità di massa, il solido occupa meno volume del liquido, mentre a parità di volume, il solido pesa di più del liquido. In altre parole possiamo solidificare un liquido per compressione.
L’acqua, però, è differente. Il ghiaccio, infatti, ha la strana caratteristica di essere meno denso dell’acqua allo stato liquido. L’osservazione di questo fenomeno è alla portata di tutti, poiché è alla base del galleggiamento dei cubetti di ghiaccio nei nostri cocktail. I più sfortunati avranno avuto un’altra manifestazione di questo fenomeno, con la rottura di qualche tubatura ghiacciata: se la temperatura scende improvvisamente sotto zero, l’acqua presente nei tubi può ghiacciare rapidamente, ma poiché solidificando l’acqua si espande, essa può arrivare a rompere il tubo. La stessa cosa può succedere mettendo una bottiglia piena e tappata nel freezer troppo a lungo: se l’acqua (o il vino) contenuto nella bottiglia solidifica completamente, può facilmente frantumare il vetro del recipiente. Un fenomeno analogo accade all’aria aperta in montagna: l’acqua infiltrata nelle fessure della roccia durante le piogge, si ghiaccia quando la temperatura scende sotto zero, provocando fratture sempre più profonde e causando, alla lunga, crolli e frane. È così che, anno dopo anno, l’acqua scolpisce i profili delle montagne o delle coste rocciose: l’acqua rappresenta uno degli agenti erosivi principali, che disegnano i nostri paesaggi.
Questa leggera differenza di comportamento ha avuto delle conseguenze enormi anche per lo sviluppo della vita sul nostro pianeta. Ad esempio permette al mare e agli oceani di ghiacciare solo in superficie e di rimanere liquido in profondità, nonostante le alte pressioni. Considerando che la vita ha avuto origine nel mare, popolandone gli abissi più profondi, possiamo intuire quanto la “stranezza” dell’acqua sia stata cruciale nella storia del pianeta. Considerando quante conseguenze abbia quest’anomalia, apparentemente piccola dell’acqua come non condividere lo stupore del piccolo Aureliano Buendia di fronte al suo primo pezzo di ghiaccio?